医疗器械唯一标识(unique device identifier,简称UDI)是对医疗器械在其整个生命周期赋予的身份标识,是产品的唯一“身份证”。UDI在医疗领域实施与应用是当今国际国内医疗器械监管与行业关注的热点。2019年10月1日国家药品监督管理局(以下简称国家药监局)发布的《医疗器械唯一标识系统规则》开始实施,标志着我国正式启动医疗器械唯一标识(UDI)实施工作。但对于这一新规定,现行法规及行业标准对UDI只是做了原则性规定,企业在具体操作过程中遇到的问题需要持续探索。本文从医疗器械生产企业的角度出发,对UDI在编码与标识、流通环节以及医疗机构应用等主要实施环节的操作要点和实践流程进行探讨。
政策要求及行业需求
国内外政策要求
美国FDA(美国食品药品监督管理局)于2013年9月24日发布了《UDI最终法规》,按照医疗器械的不同分类,要求在7年内逐步对医疗器械进行信息化管理,从而全面实施UDI标识。欧盟于2013年4月发布了医疗器械唯一标识(UDI)系统通用框架建议,并于2017年5月5日发布了体外诊断医疗器械法规(IVDR)(EU)2017/745指令,于当年5月25日正式生效。
我国的UDI相关实施工作于2012年国务院颁发的《“十二五”国家药品安全规划》开始启动,2014年国务院发布了《医疗器械监督管理条例》,2017年国务院印发《“十三五”国家药品安全规划》。2019年10月14日,国家药监局印发了《关于做好第一批实施医疗器械唯一标识工作有关事项的通告》(以下简称《通告》)。根据《通告》,自2020年10月1日起,生产列入首批实施目录的医疗器械,应当具有医疗器械唯一标识。
在国家要求“构建医疗器械编码体系、制定医疗器械编码规则”思想指导下,有关部门对实施UDI不仅进行了政策引导,还出台了相关技术标准,使实施UDI有法可依,有标准可执行,为UDI顺利实施扫清了障碍。
行业需求
医疗器械行业因涉及面广,从产品生产到临床使用经历的流通环节多,各方管理应用主体与使用场景不同,存在医疗器械标识不规范的乱象,如“一物多码”“多码并存”“无码可用”等。通常来说,医疗器械从生产到消费者需要经过生产、物流、药店、医疗机构、社保部门管理等主要应用场景。医疗器械关乎生命健康安全,为加强监管,提升医疗行业服务水平,提高医疗行业供应链透明化、信息化管理水平,提高管理效率,统一医疗器械物品编码与标识标准,遵照国家UDI法规,顺应国际化趋势,正确实施医疗器械唯一标识工作是整个医疗器械行业的使命与责任。
实施主体及实践流程
在以医疗器械生产企业为主体的UDI系统实施过程中,由生产商将UDI标识按要求标注在产品的最小销售单元及各层级需要标注的包装上,因此生产企业需要根据当前产品从包材到消费者全生命周期应用场景来进行UDI的统一编码与标识标注。实施UDI标识是以生产企业为主体的由医疗行业参与方共同应用的一个系统工程,根据UDI系统流程及实施参与方需求及功能的不同,需关注以下实施要点。
包材供应商
生产企业对需要实施UDI产品包装的包材供应商提出标识载体选用需求,可选用的主流载体符号有:一维码GS1-128、二维码GS1 DataMatrix (DM码) 、RFID标签。包材供应商应按相关标识国家技术标准进行包材印制。
生产过程
生产企业可根据需要,在产品生产包装线进行UDI编码与标识,采用变码印刷等技术进行标注,也可在成品包装加贴UDI标识。
流通过程
在物流配送、供应商管理等流通过程中,UDI标识同样可以通过其静态码传递生产厂商与产品信息,通过动态码传递产品的生产日期与有效期,如有需要还可以使用应用标识符AI(254)、全球参与方位置码(GLN)进行物理位置标注。
药店
在药店销售的医疗器械产品大多属于一类、二类风险等级较低产品,为满足药店零售扫码结算、扫码进行进销存管理等功能需求,可考虑使用GTIN-13编码,标注零售商品条码作为数据载体。
医疗机构
医疗机构的UDI管理需求主要考虑物流配送、库房管理、临床应用、质量控制、患者溯源、费用结算等几个方面,目的是要达到医疗器械的精细化管理,通过UDI标识在医疗机构各环节中快速、准确识别,完成产品物流、信息流、结算的自动化管理,提升管理效率、降低管理成本。
跨境销售
目前,美国FDA和欧盟主要使用GS1体系标准进行UDI编码,中国物品编码中心(以下简称编码中心)是GS1在我国的编码机构,也是我国认可的发码机构之一,能满足目前世界各国已发布的UDI相关规定。从实际应用以及标准化的角度,为满足跨境需求可采用GS1编码体系的UDI,既可以满足国内的合规要求,也可以出口欧美等大多数国家。
医保
医保部门对UDI标识的功能需求主要包括:医保结算、控费、打击非法套现、发现打击回流药械和查验溯源。通过正确规范地实施UDI标识系统可以满足这些需求。
操作流程及注意事项
编码与标识
UDI标识是产品包装的一部分,所以UDI的编码与标识通常由生产企业负责实施。根据行业标准YY/T 1630-2018《医疗器械唯一标识基本要求》,UDI分为UDI-DI产品标识与UDI-PI生产标识两大部分,生产企业应按照国家标准GB 12904-2008《商品条码 零售商品条码与编码表示》进行编码。
UDI-DI编码
产品标识UDI-DI为识别注册人/备案人、医疗器械型号规格和包装的唯一代码,因其编码一旦分配给产品后不能随意变动,所以也称之为“静态信息”。
生产企业在进行产品标识编码时,应按照国家标准遵循唯一性、无含义性、稳定性原则。企业在具体操作UDI-DI编码过程中,主要遇到以下两类问题。
同一产品不同层级的编码 产品的不同层级是指同一种产品的不同包装规格,如:瓶装、盒装、箱装,不同层级需要编制不同的静态码以示区别。具体有两种编码方式:编制不同的商品项目代码、编制不同的包装指示符。包装指示符为一位数字,0-8代表定量产品,9代表变量产品。根据具体情况选用两种不同的方式进行不同层级编码。
同一产品包装变动是否重新编码 国家标准对产品编码的唯一性原则要求:基本特征不相同的商品分配不同的商品代码。基本特征包括商品名称、商标、种类、规格、数量、包装类型等产品特征。UDI实施主体企业可根据这项标准来判断因产品包装变化而是否需要对UDI-DI进行重新编码。
UDI-PI编码
生产标识UDI-PI是由医疗器械生产过程相关信息的代码组成,根据监管和实际应用需求,可包含医疗器械序列号、生产批号、生产日期、失效日期等。因其编码信息随着同一种产品的不同批次、不同生产日期、需要标识到单个等原因不断变化,所以也称之为“动态信息”。
在进行生产标识编码时应充分考虑以下各方要求:1.监管部门的合规性要求;2. GS1标准规范;3.满足经营流通、药店、医疗机构、医保不同应用场景要求;4. 生产标识的核心元素(如生产日期、有效日期、批号、序列号等)。
标识制作
UDI标识载体可选用一维码GS1-128或二维码Datamatrix,可在生产线实时生成,也可按批次或单品进行标签制作后加贴在包装上,很多生产企业未按标准生成、制作 UDI标识,导致无法识读或识读错误。现将以GS1-128条码UDI制作过程示例如下:
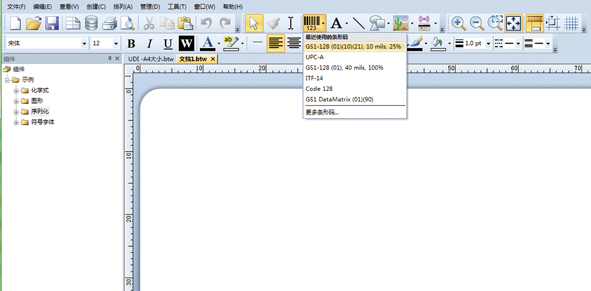
第一步:打开条码生成软件,设置需要打印的纸张尺寸,选用GS1-128条码生成UDI一维标识,如图1所示。
图1 第一步
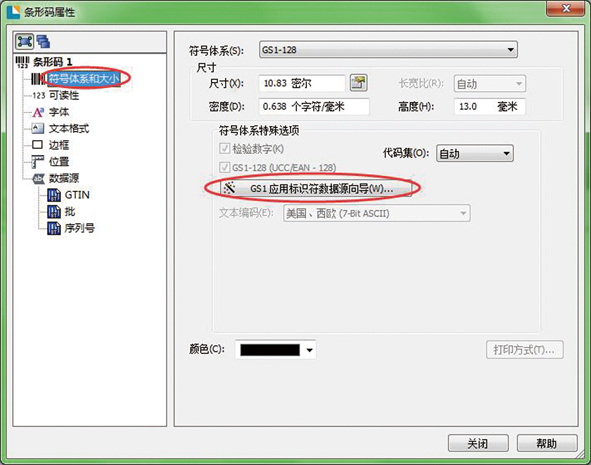
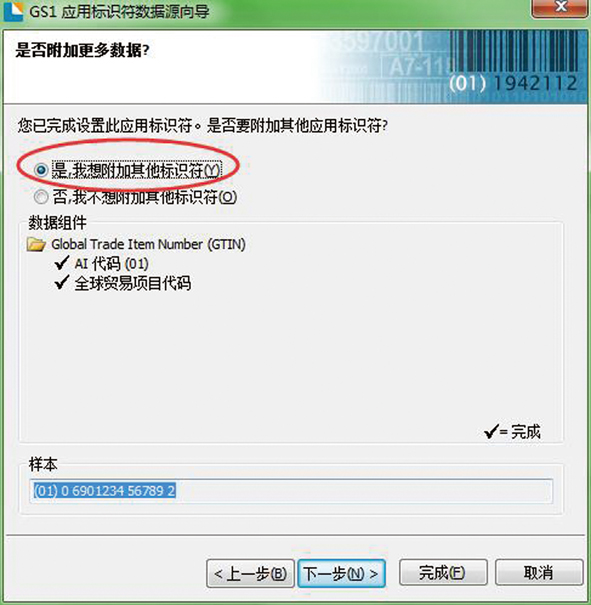
第二步:使用GS1应用标识符数据源向导,如图2所示。
图2 第二步
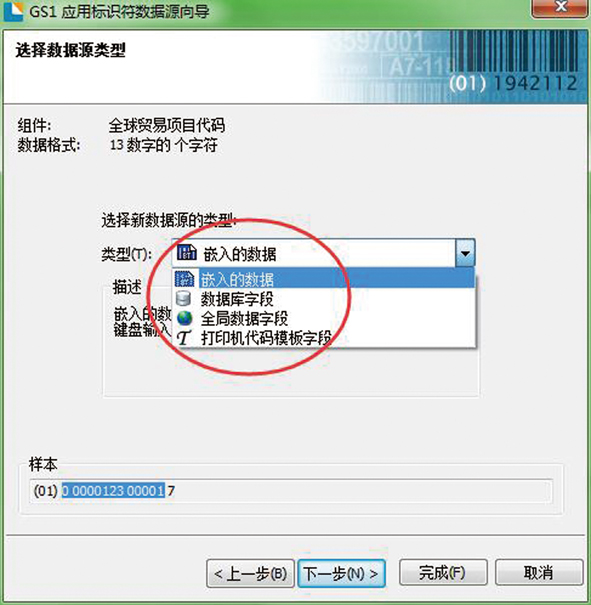
第三步:选用应用标识符,如图3所示。
第四步:选用数据类型(支持数据库导入),如图4所示。
图4 第四步
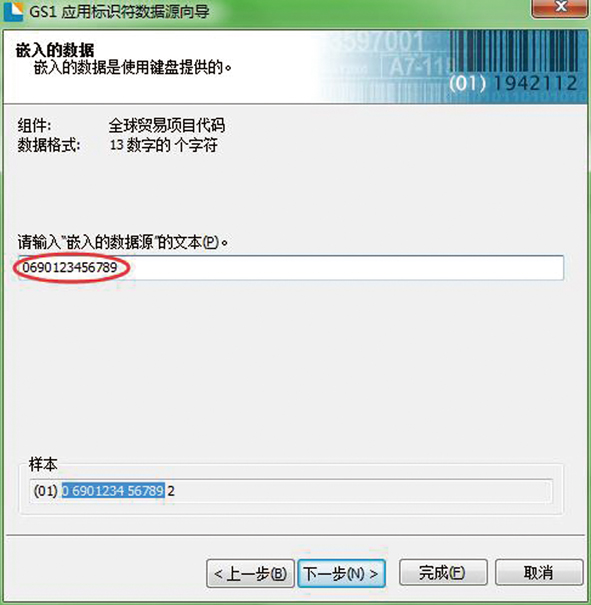
第五步:输入“嵌入的数据源”文本,GTIN可自动计算校验码,不必输入,如图5所示。
图5 第五步
第六步:继续输入其他应用标识符,如图6所示。
图6 第六步
第七步:重复第三步,直至完成所需标识编制,最后生成UDI一维标识,如图7所示。
图7 第七步
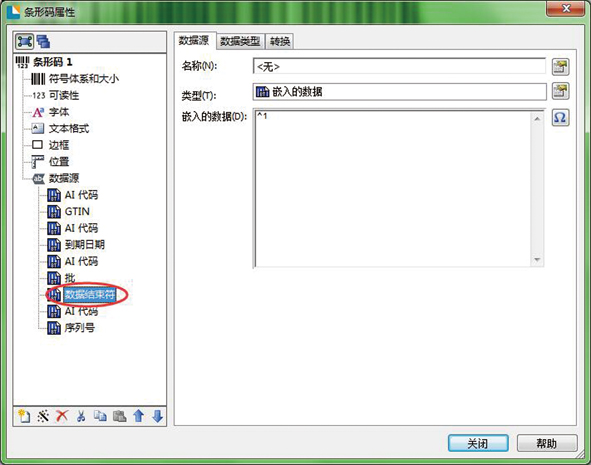
需要注意的是:推荐将固定位数的AI(如生产日期)放在前,位数非固定的AI(如批号)放在后面,而且数据后面一定要加上数据结束符,这样才能把下一段的AI符号分隔出来,避免产生误读的情况。如图8所示。
图8 添加数据结束符
数据上报
根据YY/T 1752-2020《医疗器械唯一标识数据库填报指南》,UDI生产企业可登录国家药监局官网,采用网页填报、数据模板导入和数据接口交换三种方式填报UDI数据。为方便企业快捷填报数据,企业也可登录中国商品信息服务平台(以下简称信息服务平台)填报数据,因信息服务平台上已有部分DI信息,企业只需要确认DI信息后加上PI信息即可以通过信息服务平台将UDI信息同步到国家药监局数据库。企业通过信息服务平台填报UDI信息需要注意以下几点:
药监局账号
企业必须先到国家药监局官网申请企业登录账号,如图9所示。
图9 国家药监局官网登录注册界面
绑定系统
登录到药监系统并绑定信息服务平台为数据上报系统。
申请开通UDI数据管理功能
登录信息服务平台,免费申请UDI数据管理功能,由编码中心当地分支机构审批后即可使用。
数据授权确认
注册登录后,完成编码中心传输数据的授权。
注意UDI数据信息公开日期
因UDI数据信息发布后会自动在药监局向公众公布,公布后数据不可修改,只能走变更流程,所以须慎重填报信息公开日期,建议此日期距申报当日至少15天以上,公开日之前还可以修改信息。
目前,我国的UDI工作已进入到落地实施关键时期,从政策引导、技术标准的制定发布、行业认可等方面已经具备了相对成熟的市场环境,企业作为实施UDI的主体也已经具备了实施UDI的技术条件,各医院也表达了对于统一实施UDI的强烈愿望。随着政府、企业、医疗机构以及行业协会等各方努力,将我国UDI的编码方案进一步细化、具体化,提高医疗器械识别的准确性和一致性,加大UDI行业推广应用,未来定会大大提升医疗器械管理水平和效率。
四川省标准化研究院 柳维辉
《条码与信息系统》2021年第1期总第161期