深圳迈瑞生物医疗电子股份有限公司(以下简称迈瑞)早在2016年就已经实现了美国去向医疗器械的UDI合规。我们的UDI实践工作走过了一些弯路也积累了许多实践经验,在此分享,供借鉴参考。
UDI系统简介
基于UDI法规, UDI系统一般包括以下三个方面:
1.UDI编码。UDI编码需按照官方认可的发码机构制定的编码规则编制;
2.UDI载体。UDI载体包括AIDC(机器识读)和HRI(人工识读)两个部分。UDI载体包括一维条码、二维码和RFID等,需要体现在产品或各级别的包装上;
3.UDI数据库。UDI数据库用于收录产品基本信息。对于医疗器械注册人,在产品上市前需要在官方数据库里完成UDI数据申报。
UDI系统解决了两个重要的问题,一是建立了规则相对统一的唯一化标准编码,有利于产品正确识别;二是实现了机器识读,有利于产品数据信息化。
UDI业务流程基本输出
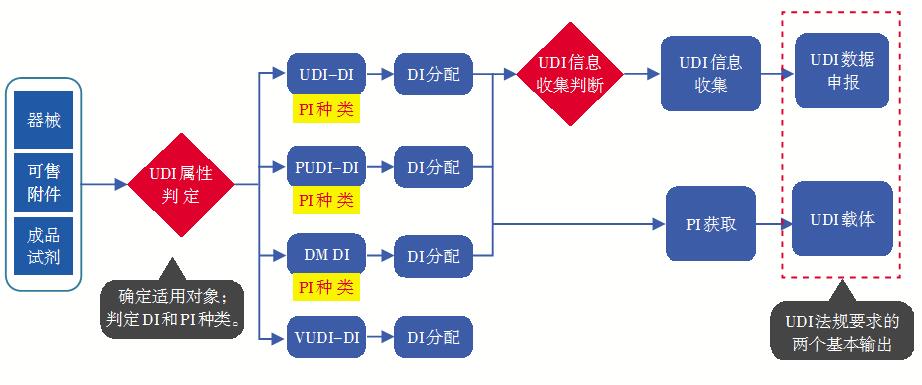
对于医疗器械注册人,基于UDI法规要求的业务基本输出包括在医疗器械本身或其各级别包装上体现UDI载体和在官方UDI数据库完成数据申报,如图1所示。UDI的编码规则要素包括产品标识(UDI-DI)和生产标识(UDI-PI),UDI系统工作第一步为UDI属性标定。UDI属性标定涉及三个方面的工作:第一,判断UDI的适用对象;第二,在确定适用的情况下判定DI种类;第三,确定PI种类。图1展示了常见的四个DI种类。
图1 UDI系统的业务输出
1)UDI-DI:主DI,美国叫Primary DI,它是中美UDI数据库的数据管理单元,需要体现在器械本身或其包装上。
2)PUDI-DI:包装DI,需要体现在更高级别的器械包装上。
3)DM DI:本体DI,也叫直接产品标识,适用于使用前需要灭菌或消毒等处理的可重复使用器械。
4)VUDI-DI:使用单元DI,也称UoU-DI。当器械使用单元或其包装上没有UDI载体时,注册人需要为使用单元分配一个DI编码,以便与主DI关联。
其中VUDI-DI不体现在产品本身或其包装上,注册人只需给它分配一个DI编码。其他种类DI对应的器械,除了需要分配DI之外,还需要收集PI信息。DI和PI构成了完整的UDI编码。
进行UDI信息收集判断主要有以下三个考虑:
1.只需要对主DI进行属性信息收集,而后在各数据库中申报,其他种类DI信息都挂在主DI的数据项下,不用单独进行信息收集。
2.非医疗器械属性信息无法在官方数据库中进行申报,所以只需要收集医疗器械的UDI属性信息。
3.若UDI信息收集流程是基于IT系统构建且采用分段多人实施的方式,那么就需要判断流程触发和流程准入的协调。
另外,构建UDI数据时应考虑兼容性,以符合各个官方数据库的数据要求。
医疗器械注册人UDI通用业务考量
UDI法规只能阐述基本的要求,单靠法规不足以指导企业UDI业务的各个方面。企业在设定UDI业务规则的时候除了参考法规,还需要考虑UDI的应用场景。以下将从注册人的角度来阐述迈瑞对几个UDI业务通用问题的理解,以供读者参考。
如何选择发码机构
法规要求企业必须选择官方认可的发码机构,我们建议企业在选择发码机构时还需要考虑客户认可度。UDI系统解决的两个重要问题之一是建立规则相对统一的唯一化标准编码,“规则统一”隐含的意思就包括UDI编码应该能被大多数的应用者所熟知,其载体应该被大多数用户的系统兼容。从这个角度上讲,企业应该选择广大销售商和医疗机构认可度最高的发码机构。迈瑞选择使用全球通用的技术成熟的GS1体系。在中国,中国物品编码中心负责GS1体系的编码发放,向中国物品编码中心申请UDI编码,中国物品编码中心还提供“UDI数据管理”,并对接国家药监局医疗器械唯一标识数据库。
如何确定UDI的适用对象
可以从法规要求和客户需求两个方面来考虑如何确定UDI的适用对象。法规要求。医疗器械是各个国家或区域UDI法规共同确定的适用对象,对此有两个问题需要着重关注。一是附件/部件是否适用各国家或区域的要求不尽相同。企业如果区别对待,那需要仔细了解器械拟销售区域的UDI法规。另外,包类器械是否适用,这个问题需要分区域对待,关于包类器械的定义,欧盟涉及“Systems and procedure packs”的要求,限于篇幅本文不展开,可参考上述对附件/部件的建议。客户需求。对象是否需要适用UDI,需与客户(一般包括销售商和医疗机构)的精细化管理要求匹配。
如何设定DI的分配规则
这个问题需要考虑的要素较多,本文主要从UDI编码与企业内部唯一化标识相衔接的角度来分析。UDI编码与内部的唯一化标识建立关联是一种相对简单的UDI赋码逻辑。常见的内部唯一化标识包括型号、物料编码、货号等。对于可配置器械,一般按照型号分配DI,试剂可按照规格的成品物料编码分配DI,附件可按照型号和成品物料编码分配DI。DI分配时需要避免“一物多码”和“一码多物”的错误发生。需要注意的是物料编码更新与DI更新之间的协调,有必要保留灵活处理的空间。假设注射器与带塑料袋包装的注射器的物料编码分别是001和002。根据最初设定的物料编码跟DI绑定的原则,应该为001和002分配不同的DI。这个时候需要考虑001和002在客户的管理体系里面是否为同一个产品,如是,则实际造成了客户眼中的“一码多物”现象。
确定PI种类时建议遵循两个原则
适用即转化。适用即转化的原则是把同级标贴或者包装上有的生产日期、效期、批号、序列号都转化为PI。对此各国家或区域要求有所不同,这个原则也是取的并集。UDI本身不创造追溯要求。这个原则是指若包装上没有生产日期、效期、批号、序列号等信息的情况,不需要仅因为UDI而额外添加。
如何选择载体
常见的载体有一维条码、二维码和RFID(无线射频识别)。一维条码使用范围广,成本低,扫描快,缺点是信息量小。如果企业想在一维条码中增加一些其他的信息如加密码,一维条码不是最佳选择。二维码的使用范围比较广,信息量比较大,可以体现一些除了UDI要求之外的信息。RFID的成本比较高,它的优点是可在不接触的情况下进行自动识读,UDI法规要求如果选择RFID作为载体,还需要附带一维条码或二维码。一般情况下UDI载体既要包括AIDC,也要包括HRI。如果是单一器械多个包装的形式,只需要把UDI标签贴在主要的包装上,不需要为每个包装分配单独的UDI。
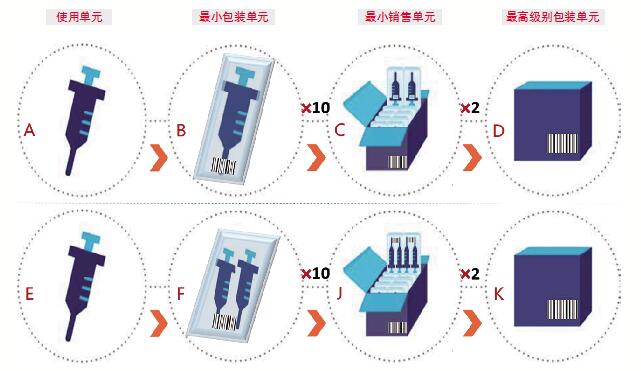
确定主DI
在设定使用单元、最小包装单元、最小销售单元、更高级别包装单元的赋码打码规则时,关键是确定主DI。除了法规要求,还需要考虑数据库限制。可参考以下原则:主DI应该对应最小包装单元。如图2所示,假设最小销售单元C的DI为主DI,一旦后续需要把最小包装单元B的DI设定为主DI,C的DI改成包装DI的操作会受到数据库规则的限制而失败。主DI之下只支持一级,即使用单元。假设图2中的最小销售单元J的DI为主DI,那么在数据申报时,对应的最小包装单元F上的DI信息将无法在数据库中承载。
图2 使用单元、销售单元、包装单元示意图
对不同类型医疗器械的考虑
对于试剂,有四个方面要注意:
1.DI分配对象是包装规格,而不是注册单元。
2.人份不宜作为使用单元, “最小销售单元中使用单元的数量”应该是1。如单独包装的单人份试剂另当别论。
3.对象是试剂而不是组分。DI的分配对象应该是成品试剂,而不是试剂中的组分。
4.试剂与指控品或者校准品一起包装构成单独包装,需要为包装分配一个单独的DI。
对于可配置器械(一般用型号来标识),DI的分配对象应该是型号,而不是可配置器械下面的特定配置组。一个可配置器械可能包括多个配置,如果每个配置组都分配一个DI的话,DI的数据管理会非常复杂。另外,一个可配置器械被拆分成多个包装进行运输时并不需要为这些包装分配单独DI。
对于组合包,要看组合包是否属于医疗器械。如果属于医疗器械,需要为组合包分配单独的DI。如果是运输包装,因为运输包装豁免UDI要求,则不需要为运输包装分配DI。中国的UDI法规对组合包没有明确的定义,可参考欧盟与美国的定义。
UDI数据库申报
这是有关UDI责任主体的问题。有四个常见的责任主体:注册人、生产商、贴标商、销售商。中国的法规规定UDI的责任主体是注册人,美国的是贴标商,欧盟的是法定的制造商。UDI责任主体可能会因销售区域不同而不同,这种情况在附件上比较常见。
编码稳定性
大多数情况下,新的器械进入医疗机构时会执行证照检查及“对码”等工作,即通常所说的“首营”。“对码”是把UDI等外部编码与医疗机构内部管理编码对应起来以便后续的物品交易和信息管理。DI更新之后,医疗机构需要重新“对码”甚至重新执行“首营”工作,这是企业需要保持UDI编码稳定性的原因之一。企业需要协调好器械变更、物料编码更新、DI更新、数据库信息更新之间的关系。
UDI的价值需要在应用中发挥,企业在制定UDI业务规则时,除了要坚守法规的要求,还需要重视使用者的需求,当相关业务存在分歧时,不妨换个角度,从使用者的视角审视一下分歧,相信分歧很快就能得到消除。
深圳迈瑞生物医疗电子股份有限公司 阳朝晖
(谢昊婧 整理)
《条码与信息系统》2021年第1期总第161期